


Die Arbeitsgruppe untersucht neue Implantatmaterialien in 3D-Zellkulturmodellen und die dynamische Kultivierung autologer (Endothel-)Zellsysteme in speziellen Pulswellen-Bioreaktoren für ein vaskuläres Graft. Mikrostrukturierte Scaffolds und neue Biotinten werden im 3D Printing designt. Daneben entstehen Lateral Flow Tests z. B. nach Nierentransplantation sowie optogenetisch aktive Zellsysteme für die Wirkstofffreisetzung im Innenohr (Hearing4All). KI-basierte Indikatoren aus komplexen Datenbanken unterstützen u. a. Versorgungsforschungsprojekte (MinDial, Fokus: nierenkranke Patienten).
Entwicklung einer Gefäßbioprothese
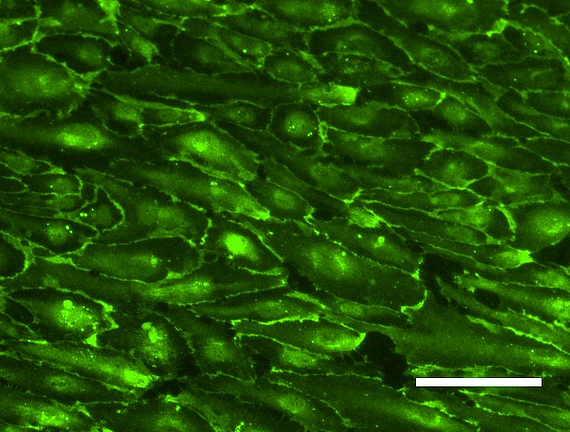
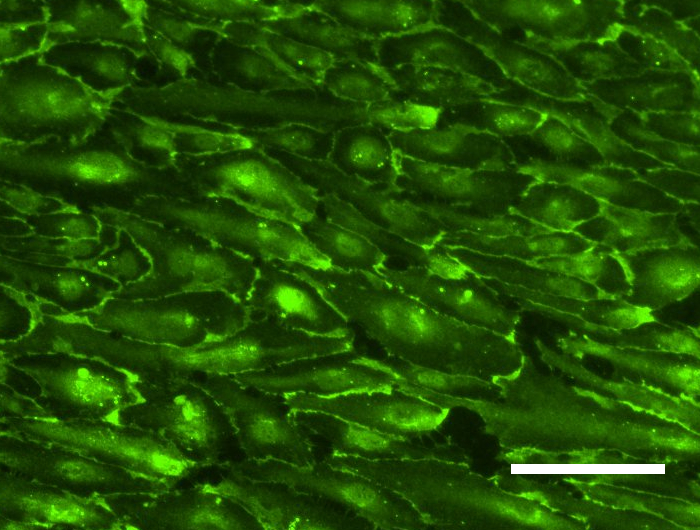

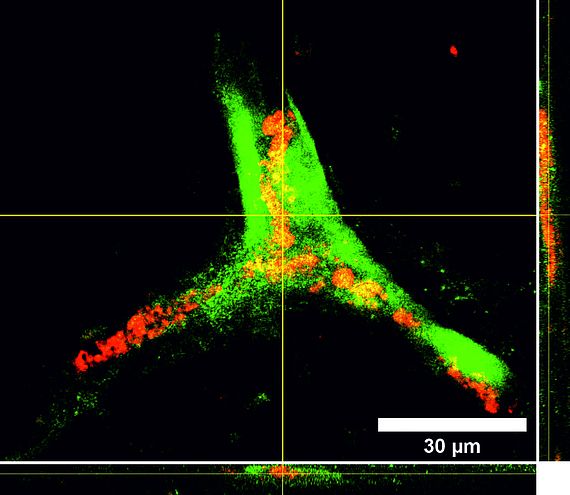
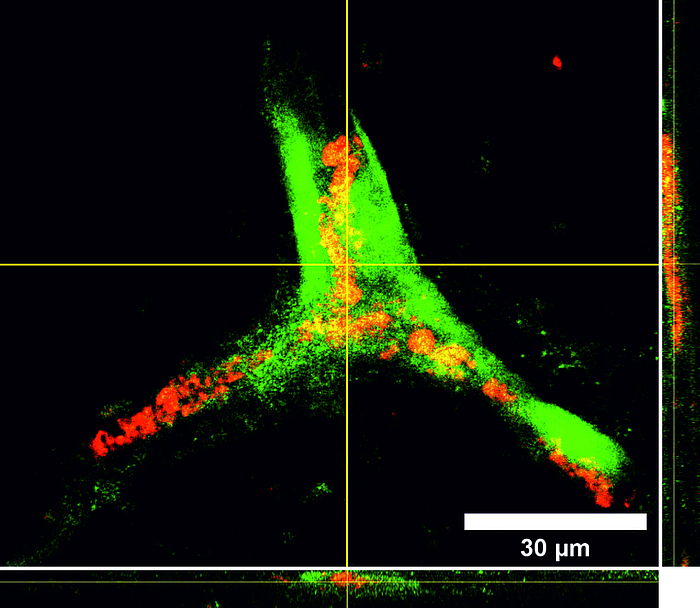
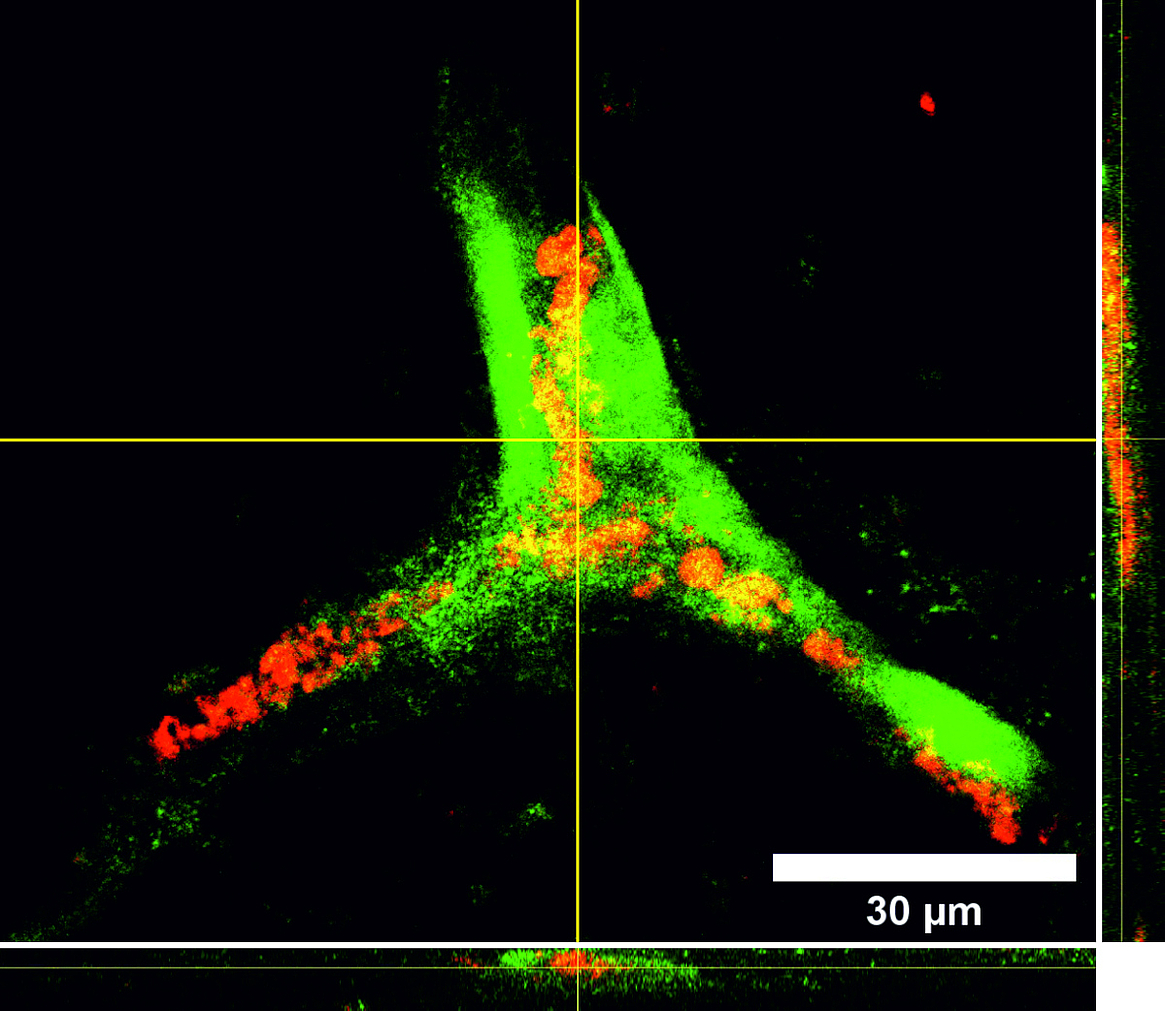
Tissue Engineering ist ein stark wachsender Sektor im Bereich der zukunftsorientierten Medizin und bietet ein enormes Potential im Bereich der Entwicklung von bioartifiziellen Gefäßprothesen, welchen in einer stark alternden Gesellschaft eine immer größer werdende Bedeutung zukommt. Eines der Hauptprobleme in der Entwicklung liegt in der Isolation und Kultivierung von Endothelzellen unter dem Aspekt der autologen Transplantation. Neuste Studien zeigen jedoch, dass humane mesenchymale Stammzellen, welche aus dem Fettgewebe von Patienten isoliert wurden (hASCs, Kooperation mit der Klinik für Plastische Chirurgie der MHH), Ansätze für die Differenzierung in eine endotheliale Richtung aufweisen und auch die Differenzierung unreifer Endothelzellen zu Kapillaren positiv beeinflussen. Wir haben daher ein Protokoll zum gezielten Einsatz der Stammzellen in Kokultur mit Endothelzellen entwickelt. Für die induzierte Sekretion proangiogener Marker spielen hier vor allem die Kultivierungsparameter Hypoxie und Scherstress eine wichtige Rolle. Parallel isolieren wir endotheliale Vorläuferzellen aus dem peripheren Blut (Kooperation mit der Blutbank der MHH) und optimieren deren extrakorporale Expansion und Entwicklung zu einer konfluenten Zellschicht auf Scaffoldmaterialien für eine Gefäßbioprothese. Hierbei spielen auch die durchflusszytometrische Analyse der spezifischen Zelluntergruppen sowie die selektive Subkultivierung eine Rolle. Zudem untersuchen wir den Einfluss verschiedener Scherstressbedingungen (statische vs. dynamische Kultivierung unter pulsatilem oder laminarem Fluss unterschiedlicher Fließgeschwindigkeiten) auf diese aus dem peripheren Blut isolierten endothelialen Vorläuferzellen.
Bioprinting und Scaffoldentwicklung



Im Bereich des Bioprinting arbeiten wir mit der AG Blume (eNIFE) an einem BioX Bioprinter der Fa. Cell-Ink (Schweden) und künftig der Fa. Regen-Hu (Basel, Schweiz) zusammen. Neuartige biodegradable Polymere werden als Scaffoldmaterial getestet und in feinsinnigen Gitterstrukturen mittels 3 D-Bioprinting / Elektrospinning-Writing gedruckt, mit einem nativen Protein beschichtet und mit Endothelzellen besiedelt. Hier besteht eine Kooperation zu Prof. Dr. M. Wilhelmi mit Arbeiten an dezellularisierten Tierarterien und der Möglichkeit von Großtierversuchen. Mikrostrukturierte Zweikomponentenscaffolds werden unter Verwendung visköser Biotinten besiedelt. Die Isolierung von Progenitorzellen aus der Blutbahn für die Endothelialisierung der Gefäßprothese wurde optimiert, dabei wurde das Prinzip dynamischer Zellkultivierung optimiert, welches Zellen unter Scherstress setzt. Mittels porogen leaching angefertigte poröse Scaffolds werden mit mesenchymalen Stammzellen und Endothelzellen (sog. HUVECS= human umbilical venous endothelial cells) kokultiviert und kapilläre Strukturen gezüchtet.
Bioreaktorentwicklung



Für die kliniknahe Bereitstellung und Kultivierung eines „vascular graft“ (bioartifizielle Gefäßprothese) entwickelte unser Arbeitskreis in Kooperation mit dem eNIFE einen funktionsgerechten Bioreaktor. Dieser reguliert im Gegensatz zu existierenden Systemen auch den Differenzierungsprozess des wachsenden Grafts und kontrolliert die Kultivierungsbedingungen. Hierfür wurden Sensorsysteme für pH, Temperatur, Glukose etc. angepasst und ein berührungsloses Monitoring über Ultraschall etabliert. Der Bioreaktor wurde 2018 bereits mit dem VDI Preis ausgezeichnet und wird nun im Sinne aktueller Konzepte der Medizinprodukteverordnung optimiert. Folgende Themen werden hier bearbeitet: Sterilitätstests, Dichtigkeitstests, Monitoringkonzepte mittels Sensorik, Druckmonitoring i. Vgl. mit Comsol-Estimierungen zum wandnahen Scherstress während einer Kultivierung, Flussmessungen mittels verschiedener röhrenförmiger Scaffolds u. a. aus Schwein und Pferd, aber auch aus dem 3 D-Biodrucker.
Biotesting
Ein weiteres Aufgabengebiet der Arbeitsgruppe ist das Biotesting. Dabei handelt es sich um das Screening unterschiedlicher pharmakologisch wirksamer Substanzen bezüglich Ihrer Auswirkung auf das Proliferationsverhalten sowie Ihrer Toxizität gegenüber humanen primären Zellen als auch Zelllinien. Für das Screening werden sowohl etablierte Assays (CTB, MTT, ECIS, Apo ONE) verwendet als auch neue Methoden etabliert, die versuchsspezifische Fragestellungen detaillierter einbeziehen. Dazu zählt die Toxizitätsbestimmung von modernen Immunsuppressiva in etablierten 3D-Sphäroidsystemen. Unsere Ergebnisse erklären beispielsweise die in der Klinik beobachtbare endothelzerstörende Wirkung des Calcineurininhibitors Tacrolimus auch unter kontrollierten klinischen Bedingungen.
HLA-I-spezifische „T-Cell finder“ nach BK-Virus-Infektion
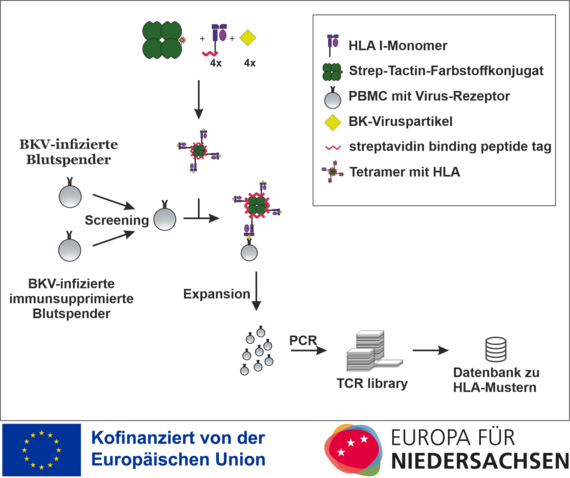
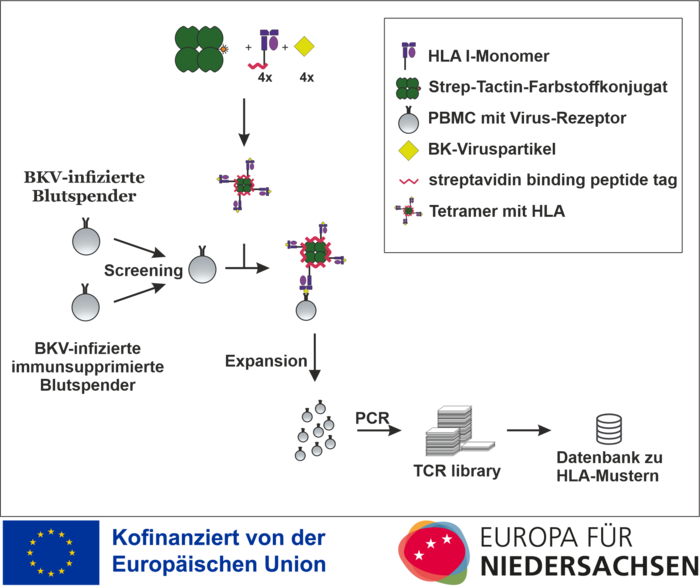
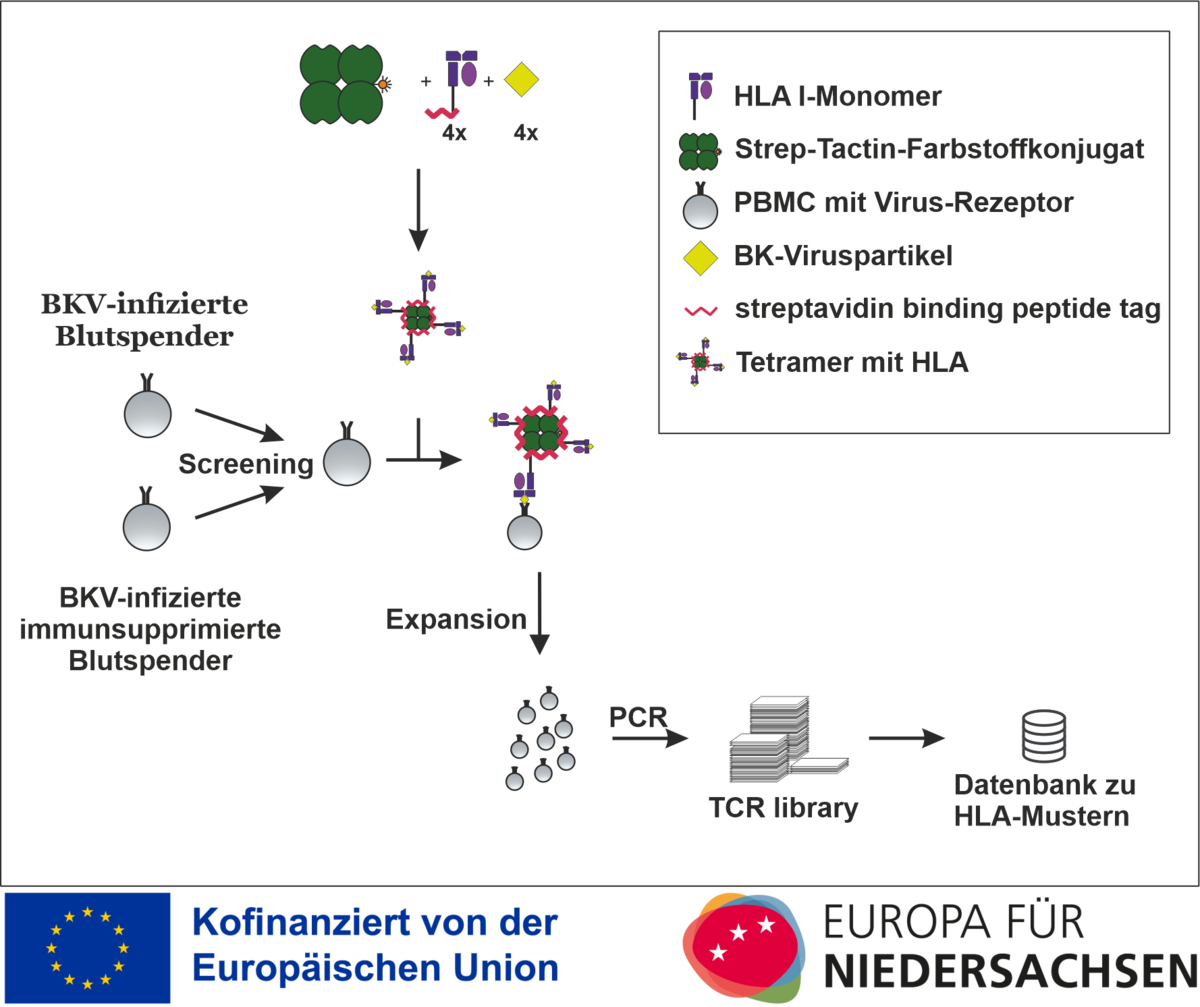
Das Projekt erhält Zuwendungen aus Mitteln des Europäischen Fonds für Regionale Entwicklung (EFRE) und des Landes Niedersachsen und befasst sich mit HLA-Streptameren zur Verbesserung der Diagnostik sowie einer individualisierten T-Zell-Therapie bei Polyomavirusinfektion nach einer Transplantation.
Die Nierentransplantation als Therapie der Wahl bei terminalem Nierenversagen und die Knochenmarktransplantation /Stammzelltransplantation sind die wesentliche therapeutische Säule bei der Behandlung maligner hämatologischer Erkrankungen. Diese machen in der Regel lebenslange immunsystemunterdrückende (immunsupprimierende) Maßnahmen erforderlich, um das Auftreten akuter und chronischer Abstoßungsreaktionen zu verhindern. Der Einsatz immunsuppressiver Therapien geht jedoch mit einer erheblich erhöhten Infektanfälligkeit bei diesen Erkrankten einher. So kann eine Infektion mit dem BK-Virus (BKV) bis zu einer chronischen Polyomavirus-Nephropathie (PVAN) führen. Die Reduktion der Immunsuppression birgt jedoch zugleich die Gefahr einer akuten oder chronischen Abstoßungsreaktion oder einer Graft-versus-Host-Disease. Sowohl die PVAN als auch diese unerwünschten Abstoßungsreaktionen, die nur per Biopsie zu sichern sind, können zu einer Nierenfunktionsverschlechterung bis hin zur Dialysepflichtigkeit führen.
Aus diesem Grund werden präventive Screeningverfahren zur BK-Virämie empfohlen. So werden in diesem Projekt BKV-spezifische HLA-I-Streptamere bei gesunden Blutspenden nach BKV-Infektion zur T-Zell-Detektion und T-Zell-Isolation eingesetzt, bevor sie für immunsupprimierte PatientInnen optimiert werden.
-
Projektplan
Nach Auswahl verschiedener BKV-spezifischer Viruspartikel werden virusbeladene HLA-I-Monomere (imusyn) mit Streptactin (iba) zu HLA-I-Streptameren kombiniert und auf ihre Viruspartikelbindung hin überprüft. Diese virusspezifischen Streptamere werden dann genutzt, um aus in vitro kultivierten Proben von BK-infizierten gesunden Blutspendern BKV-spezifische Zellen zu gewinnen und zu vermehren. Die Immunaktivität der erhaltenen T-Zellen wird mittels ELIspot überprüft. Dasselbe Verfahren soll dann für immunsupprimierte PatientInnen mit (wie zu erwarten) geringerer Präsenz an virusspezifischen T-Zellen optimiert werden. Nach Identifikation von BKV-spezifischen HLA-I-spezifischen T-Zellen (CD8+Zellen = T-Killerzellen) wird ein T-Zell-Rezeptor-Scan durchgeführt, die Gencodes durch in vitro Translation überprüft und in einer T-Zell-Rezeptor-library abgelegt.
Daneben wird ein Lateral Flow Assay zur Detektion des bei PVAN im Urin nachweisbaren Chemokins CXCL10 zusammen mit der Fassisi GmbH optimiert und als Point-Of-Care-Test für PVAN-PatientInnen evaluiert. Der Lateral Flow Assay für CXCL10 wird statistisch vorbereitet, zusammen mit Fassisi als serienreliabler Test aufgebaut, an Realproben von Nierentransplantierten mit PVAN evaluiert und auf Test-Performance überprüft.
-
Kooperation
Das Projekt wird im Verbund mit dem Institut für Transfusionsmedizin und Transplantat Engineering, der Klinik für Nephrologie der Medizinischen Hochschule Hannover sowie der Abteilung für Information und Kommunikation der Hochschule Hannover durchgeführt.
Weitere Beteiligte:
Optogenetik
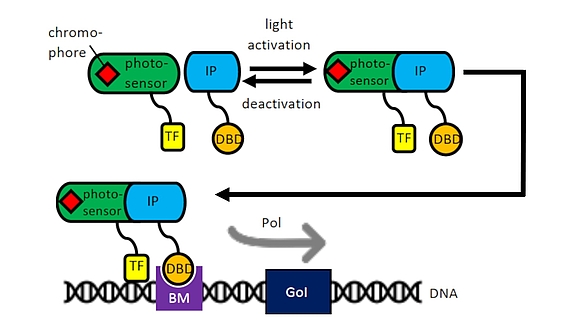
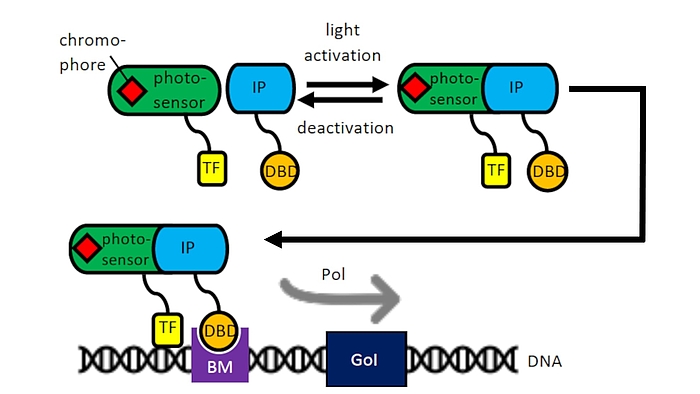
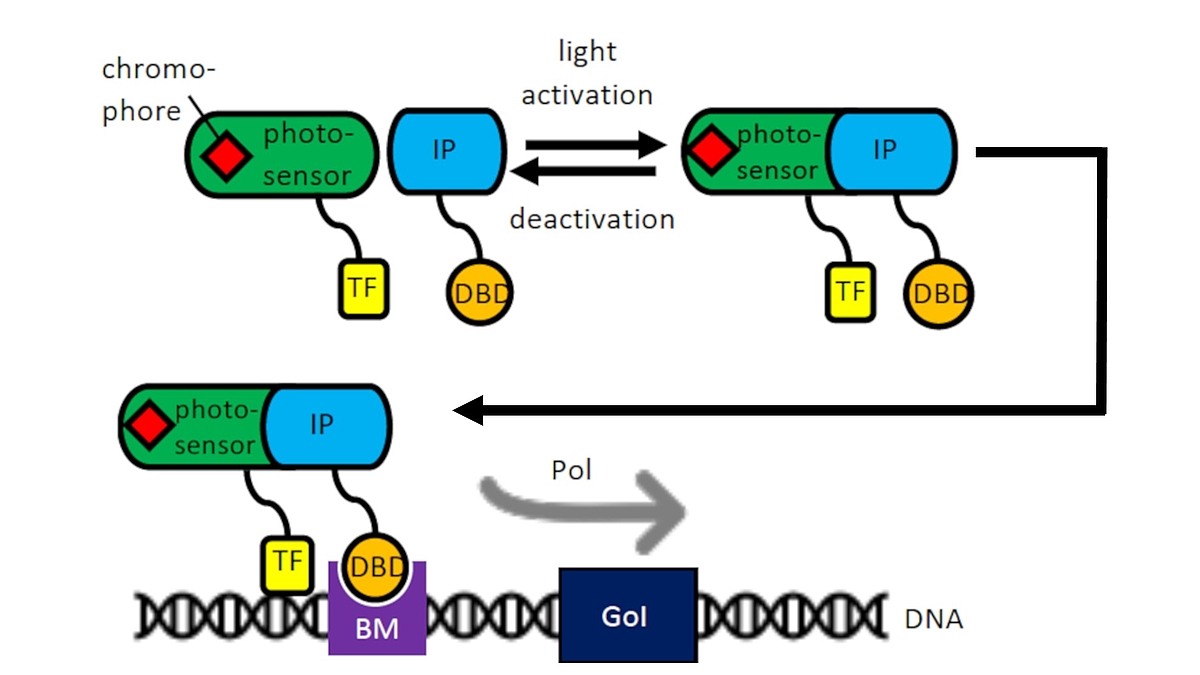
Als Teil des Exzellenzclusters Hearing for All nutzen wir unsere Erfahrung mit mesenchymalen Stammzellen und Zelltransfektionen für die Entwicklung optogenetisch aktivierbarer Zellen für die humane Therapie. Über Lichtinduktion mittels eines optogenetischen Schalters soll in Kooperation mit der AG von Fr. Prof. A. Warnecke die Transkription bestimmter pharmakologisch oder neuroprotektiv bedeutsamer Proteine z. B. während der Einheilung von Cochleaimplantaten im Rahmen von begleitenden Zelltherapien induziert werden. Auch für die Aktivierung von Nanopartikeln im „Drug Delivery“ können so Enzyme gezielt angeschaltet werden (Kooperation mit der AG Prof. P. Behrens, Anorganische Chemie, NIFE). Ein optogenetisches System der AG von Prof. W. Weber, Universität Freiburg konnte bereits in CHO-Zellen erfolgreich für die Induktion durch Lasersysteme der AG Prof. A. Heisterkamp im NIFE optimiert werden und wird derzeit auf mesenchymale Stammzellen aus dem Fettgewebe oder aus dem Knochenmark übertragen.
Datenbankprojekt Chronisch Nierenkranke



Dieses Projekt befasst sich mit der Auswertung einer von der KfH-Stiftung Präventivmedizin e. V. finanzierten longitudinalen Datenbank zu chronisch nierenkranken Patientinnen und Patienten, die auf Daten deutschlandweiter klinischer Studien beruht. Die Datenbank enthält Angaben zu deren Krankheitszustand über die Zeit sowie Laborwerte. Die Längsachse des Projekts erstreckt sich über 6-7 Jahre, so dass das Voranschreiten des Nierenfunktionsverfalls unter Einfluss bestimmter Parameter beobachtet werden kann. Auf Basis der Daten konnte ein Innofond-finanziertes Projekt im Bereich Versorgungsforschung eingeworben werden. In diesem Projekt soll ein Risk-Score für die Einschätzung des Risikos, einmal Dialysepatient zu werden, evaluiert, berechnet und erprobt werden. Diese Patienten werden in vier benachbarten Kliniken der Knappschaft (einem Gesundheitsanbieter, der gleichzeitig Versicherer ist) im Raum Essen-Bottrop rekrutiert und mit einem automatisierten Entlassmanagement versorgt werden. Jeder Knappschaftspatient, der dort aufgenommen wird, wird im Rahmen seines klinisch-stationären Aufenthalts gescreent. Patienten, die ein Risiko von 15 % oder höher für Dialyse in den nächsten 5 Jahren aufweisen, werden automatisch an einen Facharzt für Nephrologie überwiesen und dort weiter betreut. Die Effizienz dieser Maßnahme wird im Projekt bewertet und kann – bei Erfolg – Eingang in die gängige und abrechenbare klinische Versorgungs-Praxis erhalten. Partner im Projekt sind - neben den Knappschaftskliniken und dem dort ansässigen Nephrologen Prof. Dr. Hollenbeck - Prof. Binder an der Universität Freiburg (Evaluator) und das IMIBE (Institut für Medizinische Informatik, Biometrie und Epidemiologie) in Essen.
Mobile Corona Analytik Projekt (MCA)
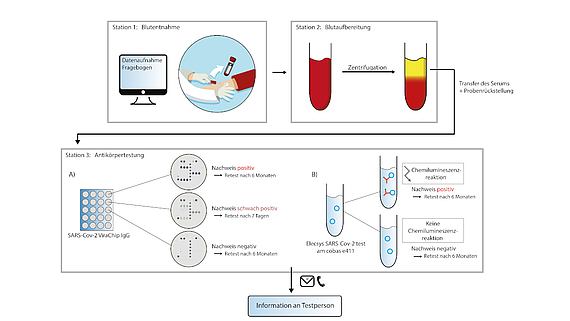
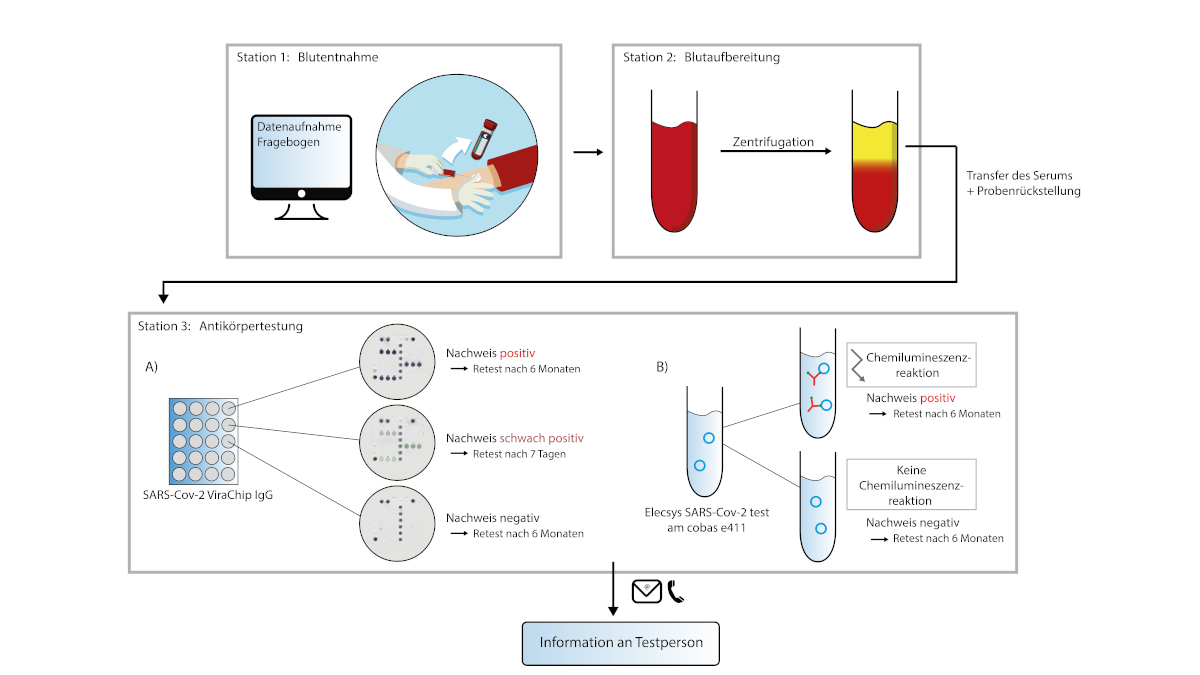
Der Arbeitskreis beteiligte sich am MCA Projekt mittels des Aufbaus von mobiler SARS-CoV-2 Analytik per Rachenabstrich am Diagnostik-Container, des Qualitätsmanagements nach RiLibaek und einer medizinischen Betreuung. Insbesondere wurde ein immunologisches Screening etabliert, welches die Bewertung verschiedener Testsysteme erlaubt.
Bei der Ärztekammer Niedersachsen wurden drei Studien zur SARS-CoV-2-Akutdiagnostik, zum Ak-Screening und zur Immunitätsuntersuchung in Berufsgruppen im Großraum Niedersachsen in Kooperation mit Coronavirusforschern an der Tierärztlichen Hochschule Hannover eingereicht und nun durchgeführt.
Kontakt


30167 Hannover



