

 ©
Harry Köster/ harry-koester.de
©
Harry Köster/ harry-koester.de
Die Arbeitsgruppe widmet sich der Erforschung innovativer Strategien zur in vitro-Expansion und gezielten Optimierung der Kultivierungsbedingungen für humane und Säugetierzellen, um deren Anwendungsmöglichkeiten in Forschung, Medizin und Biotechnologie zu erweitern. Neben konventionellen Kultivierungstechniken, wie der statischen zweidimensionalen (2D) Zellkultur, werden auch dreidimensionale (3D) Zellkultursysteme etabliert und charakterisiert.
Humane MSCs, Zelllinien und Primärzellen werden als Zellaggregate, auf Scaffolds und in Hydrogelen unter physiologisch relevanten, in vivo-ähnlichen Bedingungen kultiviert. Um komplexe in vitro-3D-Systeme zu ermöglichen, werden mithilfe von Bioinks und Bioprinting realitätsnahe 3D-Modelle für das Drug Screening entwickelt.
Darüber hinaus untersucht die Gruppe den Einfluss verschiedener in vitro-Gradienten (z. B. Sauerstoffkonzentration, Steifigkeit, Wachstumsfaktoren) auf das Zellverhalten in Hydrogelen. Ziel ist es, durch dieses Testsystem den kombinierten Effekt mehrerer Parameter präzise zu analysieren und optimale Kulturbedingungen für spezifische Anwendungen zu identifizieren. Zudem wurden verschiedene Zelltypen mit genetisch kodierten Sensoren (Hypoxie, Apoptose, YAP/TAZ, Glukose etc.) modifiziert und ihre Reaktionen in unterschiedlichen 3D-Kultivierungssystemen (Zellaggregate, Hydrogele, Scaffolds) untersucht. Hierfür werden speziell entwickelte Mikroskopie-Objektive sowie KI-gestützte Algorithmen zur Zell- und Signalerkennung eingesetzt.
In Kooperation mit Cultimate Foods GmbH entwickeln wir außerdem Bioprozesse zur Produktion von kultiviertem kulinarischem Fett. Dabei werden aus Rindern und Schweinen isolierte Stammzellen ex vivo expandiert und in Adipozyten differenziert, um Fett zu erzeugen, das pflanzenbasierten Fleischalternativen zur Geschmacks- und Nährstoffoptimierung zugesetzt wird.
KI-gestütztes Monitoring und Analyse von 3D-Zellkulturen


 ©
Harry Köster/ harry-koester.de
©
Harry Köster/ harry-koester.de
In Zusammenarbeit mit Sartorius AG, AG Lindner und dem Yoav Schechtman Lab am Technion entwickeln wir innovative Methoden zur präzisen und effizienten Zelllokalisierung in Zellaggregaten und 3D-hydrogelbasierten Konstrukten. Durch die Verwendung von Standard- und Extended Depth-of-Field (EDOF)-Objektiven in Kombination mit KI-gestützten Algorithmen optimieren wir die schnelle und genaue Erkennung von Zellen in Brightfield-Z-Stack-Bildern. In Verbindung mit Weitfeld-Fluoreszenzbildgebung und dem IncuCyte® Imaging System ermöglicht dieser Ansatz die Analyse fluoreszierender Sensorzellen, wodurch lokale Sensorsignale in Echtzeit beobachtet und räumliche Heatmaps zur Zellreaktion in 3D-Kulturen erstellt werden können.
Gradiente in Hydrogelen
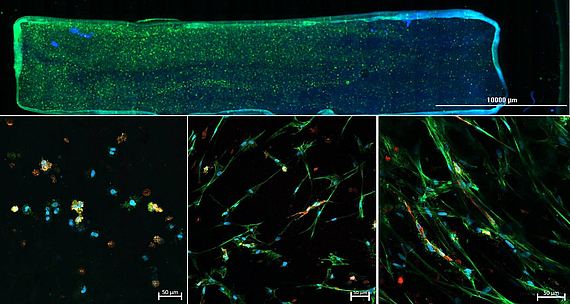
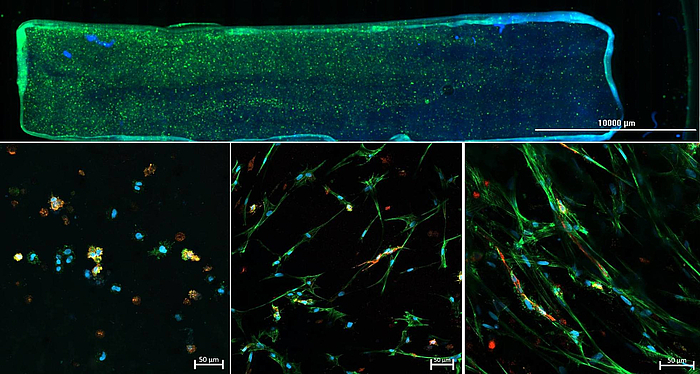
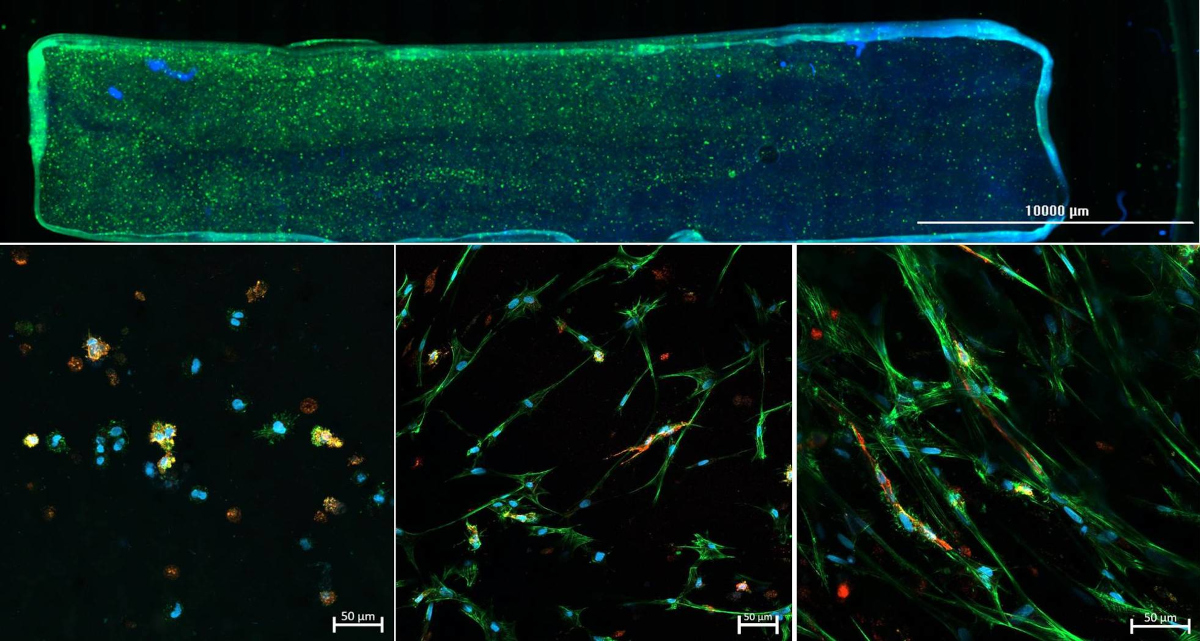
Im Rahmen des Projektes „3D Zwei Gradienten Systeme für funktionelle Zelltestung“ (398007461), durch die DFG gefördert, entwickeln wir Hydrogel-basierte in vitro Gradienten. Dabei wird durch unterschiedlich starke Vernetzung ein mechanischer Gradient in das Hydrogel eingebracht. Orthogonal dazu wird ein Sauerstoffgradient etabliert, sodass innerhalb eines Experiments sämtliche Kombinationen aus Hydrogelzusammensetzung und Sauerstoffkonzentration getestet werden können. Mit Hilfe des neuartigen Testsystems soll es zukünftig möglich sein rasch und zuverlässig den kombinierten Einfluss verschiedener Faktoren auf das Zellverhalten zu ermitteln, um optimale Kulturbedingungen für die jeweilige Anwendung zu finden.
Integration genetisch codierter Biosensoren für Echtzeit-Monitoring in 3D


 ©
Harry Köster/ harry-koester.de
©
Harry Köster/ harry-koester.de
Im Rahmen des interdisziplinären Forschungsverbunds Matrix Evolution, gefördert vom Niedersächsischen Ministerium für Wissenschaft und Kultur, ist die AG Lavrentieva mit dem Teilprojekt „MatrixSense“ am Institut für Technische Chemie tätig. Der Fokus liegt auf der Integration genetisch kodierter Biosensoren in relevante Zelltypen sowie der Charakterisierung von Reporter-Zellen in 2D- und 3D-Zellkultursystemen. Zudem entwickeln wir Strategien zur Online-Evaluierung der räumlich-zeitlichen Zellantwort auf Einzelzellebene innerhalb chirarchisch strukturierter 3D-Matrizen. Dafür integrieren wir Hypoxie-, Apoptose-, YAP-, Aktin-, pH- und Vinculin-Sensoren in MSCs und Endothelzellen.
Zur Überwachung der zellulären Signalwege nutzen wir ein innovatives Live-Cell-Analysesystem mit hochauflösender Fluoreszenzbildgebung. Dies ermöglicht es, komplexe biologische Veränderungen in Echtzeit zu beobachten und präzise zu quantifizieren.
In vitro kultiviertes Fett


 ©
Harry Köster/ harry-koester.de
©
Harry Köster/ harry-koester.de
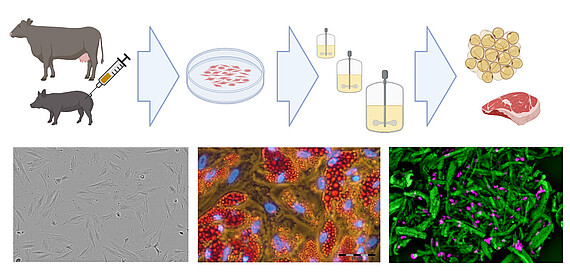
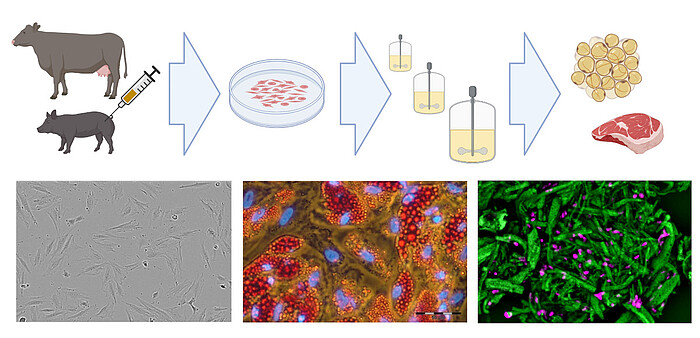
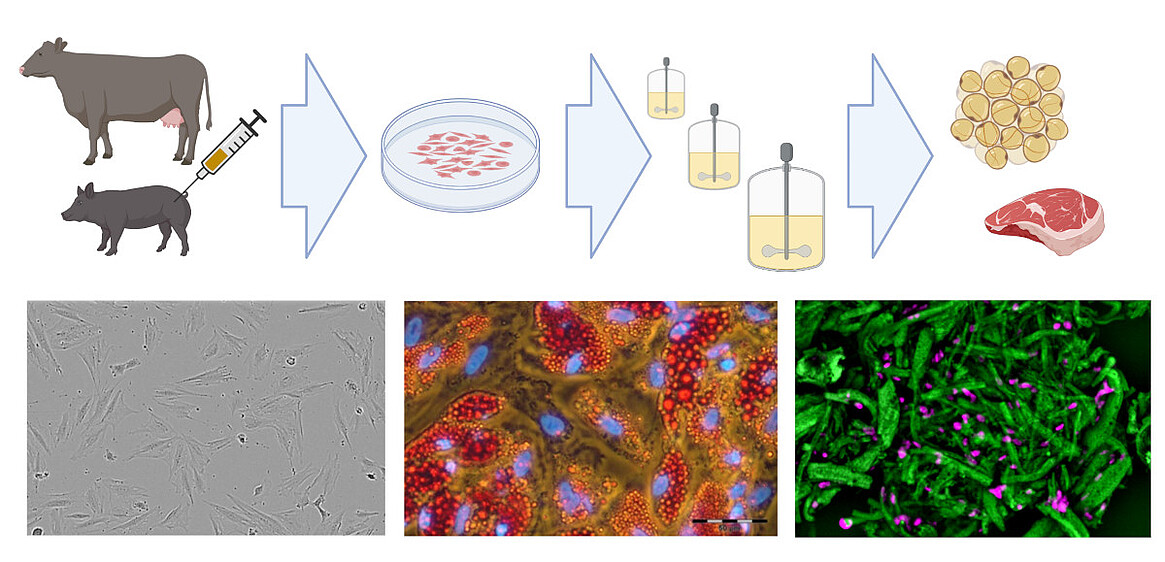
Vorhandenes Know-how in der Kultivierung von Säugetierzellen (einschließlich der Kultivierung mesenchymaler Stammzellen) kann auch auf den schnell wachsenden Bereich der neuartigen Lebensmittel, insbesondere der „cellular agriculture“, übertragen werden. Hier werden aus landwirtschaftlich relevanten Arten isolierte Zellen ex vivo expandiert und differenziert, um entweder Zellbiomasse für unstrukturiertes Fleisch oder in Gerüsten wachsende Zellen für strukturierte Fleischanaloga zu produzieren. In Zusammenarbeit mit dem Start-up Cultimate Foods aus Berlin/Hannover entwickelt unsere Arbeitsgruppe Bioprozesse zur Isolierung, Expansion und Differenzierung von verankerungsabhängigen Schweine- und Rinderzellen zur Herstellung von zellkultiviertem Fett. Die Herstellung von kultiviertem Fett für Lebensmittel ist eine Herausforderung, da ein kostengünstiger Prozess erforderlich ist, der nur Zellkulturkomponenten in Lebensmittelqualität enthält. Dennoch gibt es bereits erste vielversprechende Ergebnisse, die der Technologie große Hoffnung machen.
Kontakt


30167 Hannover



